
資訊 
了解行業以及華進新聞資訊。
從瑞德西韋“搶注”談醫藥用途專利的申請、保護和布局策略(上)
2020-02-21
作者:信建 華進國內專利事業部

信建
華進國內專利事業部
北京生物與化學部主管
碩士畢業于山東大學神經生物學系,曾發表SCI論文三篇,其中一篇第一作者IF=7.869。自2015年起從事專利代理工作,擅長生物醫藥相關技術領域專利國內專利的分析、布局、撰寫、復審、無效等事務。
導語
文章中提到:
瑞德西韋(Remdesivir,GS-5734)是核苷類似物,目前在剛果(金)開展治療埃博拉出血熱的Ⅱ和Ⅲ期臨床研究。磷酸氯喹(Chloroquine)于上個世紀40年代起用于治療瘧疾,后用于治療類風濕性關節炎等。上述兩種藥物在細胞水平上有效抑制2019新型冠狀病毒感染的初步結果此前已通過多種形式向國家和省市相關部門報告。為服務于疫情防控,合作雙方單位聯合聲明:在上述具有抗2019新型冠狀病毒(2019-nCoV)作用的藥物中,我們對于國內已經上市并能夠完全實現自主供應的藥物磷酸氯喹,不申請相關專利,以鼓勵相關企業參與疫情防控的積極性;對在我國尚未上市,且具有知識產權壁壘的藥物瑞德西韋,我們依據國際慣例,從保護國家利益的角度出發,在1月21日申報了中國發明專利(抗2019新型冠狀病毒的用途),并將通過PCT途徑進入全球主要國家。如果國外相關企業有意向為我國疫情防控做出貢獻,我們雙方一致同意在國家需要的情況下,暫不要求實施專利所主張的權利,希望和國外制藥公司共同協作為疫情防控盡綿薄之力。
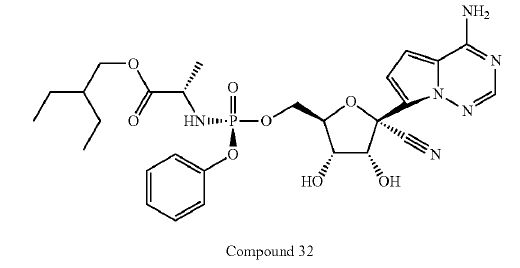
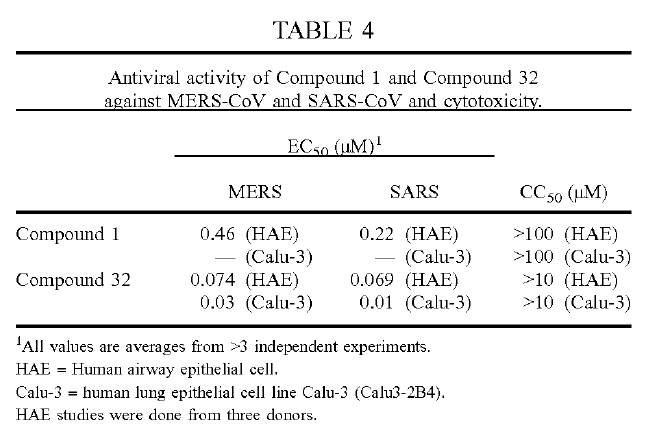

我國專利法第二十六條第四款規定:
權利要求書應當以說明書為依據,清楚、簡要地限定要求專利保護的范圍。
專利法第二十六條第四款中有關權利要求應當得到說明書支持的規定的立法本意在于平衡專利權人與公眾利益,專利權人所得到的權益應當與其實際所做的貢獻相匹配。
《專利審查指南》第二部分第二章:
第3.2.1節明確規定,權利要求書應當以說明書為依據,是指權利要求書應當得到說明書的支持。
例:
在“胃腸基質腫瘤的治療”發明專利權無效宣告請求案 [3] 中,合議組認為對于以“某物質在制備用于治療某疾病的藥物中的應用”形式撰寫的醫藥用途權利要求,“治療某疾病”應理解為對患有某疾病的患者進行治療,其中“患者”既包括病人,也包括動物患者。盡管如此,在說明書中提供臨床試驗數據并不是為此類醫藥用途權利要求提供支持的唯一方式,在說明書中提供體外細胞實驗或動物模型實驗也是可選方式,但采用這些方式時應達到使本領域技術人員根據說明書提供的內容能夠預期該物質具有所述用途和/或效果的程度。換言之,若權利要求請求保護藥物對人體患者進行治療,其支持程度并不意味著在臨床試驗時能夠達到絕對的成功,而只需使得本領域技術人員對以該藥物治療人體患者的成功性有合理的預期即可。
綜上
Copyright ? 2021 華進聯合專利商標代理有限公司.All Rights Reserved.粵ICP備12081038號